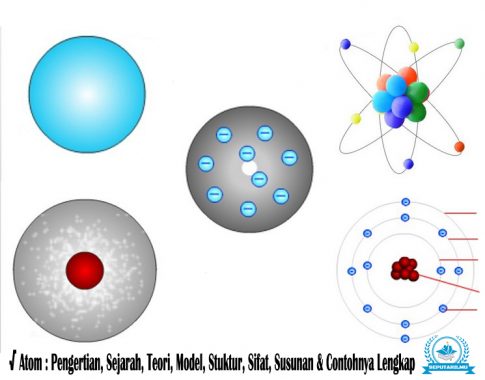
Pengertian Atom
Kata atom ini berasal dari bahasa Yunani “Atomos” yang berarti tidak dapat dibagi-bagi. Semua material di dunia ini memiliki bagian yang sangat kecil-kecil, sehingga jika bagian tersebut dibagi lagi, maka terdapatlah bagian paling kecil yang tidak dapat dibagi lagi, hal itulah yang disebut juga dengan atom.
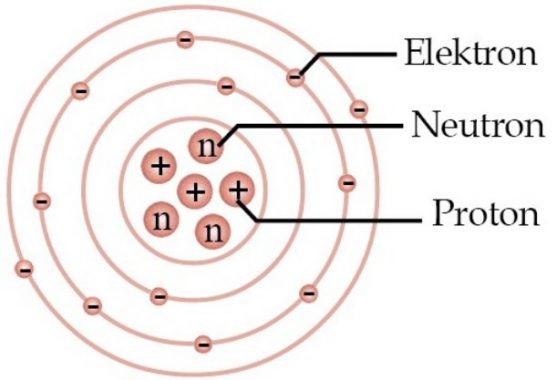
Atom adalah suatu penyusun materi terkecil dari segala materi yang ada. Atom ini terdiri dari nucleus (inti atom), dan dikelilingi oleh elektron yang memiliki muatan negative. Pada inti atom ini terdapat proton yang berumatan positif dan neutron yang tidak memiliki muatan (netral).
Atom ini memiliki diameter sekitar 6-30 nm. Partikel-partikel seperti proton, neutron dan electron juga terikat dengan atom oleh karena adanya suatu gaya elektormagnetik.
Karena gaya elektromagnetik pula, atom dapat bergabung bersama dengan atom-atom yang lain sehingga dapat membentuk sebuah molekul. Sampai dengan saat ini, belum ada satupun alat atau teknologi yang dapat melihat suatu atom itu.
Pengertian Atom Menurut Para Ahli
1. Leucipus dan Democritus
mengatakan bahwa atom adalah suatu bagain terkecil dari suatu materi yang tidak dapat dibagi lagi menjadi bagian-bagian tertentu. Atom ini merupakan penyusun segala materi yang ada di dunia ini.
2. John Dalton
mengatakan bahwa atom ialah suatu partikel terkecil daripada suatu zat yang tidak dapat diuraikan lagi menjadi partikel yang lebih kecil melalui reaksi kimia biasa.
3. Joseph John Thompson
berpendapat bahwa atom merupakan sebuah bola yang bermuatan positif yang dikelilingi oleh electron seperti roti kismis.
4. Ernest Rutherford
berpendapat bahwasanya atom ialah suatu partikel yang terdiri dari neutron dan proton serta dikelilingi oleh electron.
5. Demokritos
berpendapat bahwa atom adalah suatu kumpulan partikel kecil dalam jumlah banyak kemudian melekati dan menyusun hampir seluruh materi yang ada di alam semesta. Dalam kata lain teori ini menyebutkan jika materi yang ada di bumi dan isinya merupakan suatu bagian dari unsur atom.
6. J. Desaulx
ini adalah salah satu Fisikawan yang berasal dari Jean Perrin. Ia telah melakukan eksperimen mengenai masa atom dan juga turut mengemukakan pendapatnya tentang teori atom dengan menggunakan percobaan dari karya buatan Einstein yang kemudian langsung digunakan untuk mengujicoba besaran masa dan atom pada sebuah katoda.
7. Lavoisier
pada tahun 1789 Lavoiser mengemukakan pengertian atom dengan istilah suatu unsur yang merupakan salah satu bahan dasar yang memiliki kemampuan yakni tak dapat dibagi lagi meskipun dianalisa dengan menggunakan metode kimia.
8. Robert Boyle
menurut Robert Boyle pada tahun 1661 beliau mengemukakan pengertian atom dengan meluncurkan sebuah buku yang berjudul “The Sceptical Chymist”. Didalam bukunya yang berisi tentang teori atom dimana dunia dan isinya (materi yang terkandung didalamnya) adalah hasil bentukan dari suatu kombinasi beragam atom yang berbeda.
9. Stern Gerlach
teori atom terus berkembang hingga pada tahun 1922, seorang Ilmuwan bernama Stern Gerlach mengemukakan pendapatnya tentang pengertian suatu atom dari hasil penelitiannya membuktikan bahwasanya atom ini memiliki sifat yang kauntum.Hal tersebut didapat dari uji coba yang telah dilakukan saat sinar atom perak diberikan sedikit tekanan melalui medan magnet yang kemudian data atau benda tersebut digerakan secara terpisah hingga membentuk suatu sudut spin lalu hasilnya bagian berkas tersebut bergerak menyebar tak menentu yang dapat menghasilkan kesimpulan tergantung pada spin atom tersebut melintas apakah keatas atau kebawah.Terdapat penekanan yang harus dimengerti oleh setiap orang bahwasanya atom ini tidak dapat dibagi lagi yang memiliki artian bahwa atom yang masih dapat dibagi seperti halnya atom oksigen yang dipisah dari partikel dasar proton, neutron dan elektron yang bukan merupakan sebuah atom lagi, melainkan sudah menjadi ion.Artinya, jika atom tersebut dipisahkan dengan suatu zat atau partikel dasarnya, maka zat tersebut tidak dapat dikatakan atom lagi, sudah menjadi ion.
10. Bohr
berpendapat dari suatu kegagalan dari teori Rutherford, mengundang seorang ilmuwan bernama Bohr untuk mencoba melengkapi sekaligus memperbaiki sisi lemah dari teori sebelumnya dengan tiga ketentuan, yaitu :
- Kententuan pertama seputar rotasi yang dibuat elektron dengan yang mengelilingi inti dengan sebutan lintasa stasioner.
- Ketentuan kedua mengatakan bahwasanya elektron ini memiliki kemampuan untuk melakukan perpindahan dari satu lintasan ke lintasan yang lain sesuai dengan rotasi yang ada.
- Lintasan-lintasan yang diperkenankan elektron adalah suatu lintasan-lintasan yang mempunyai momentum sudut kelipatan bulat.
Sejarah Penemuan Atom
Sejarah tentang penemuan atom ini dimulai ketika John Dalton mengggas sebuah teori tentang atom pad atahun 1803. Kemudian, terdapat beberapa penelitian yang dapat mendukung teori atom yang dikemukakan oleh John Dalton, seperti Michael Faraday yang menemukan teori pemecahan suatu molekul menggunakan elektrolisis pada tahun 1832, dan J.Plucker yang dapat menemukan tabung katoda pada tahun 1839.
Kemudian diikuti penemuan oleh Dmitri Mendelev tentang hukum periodic pada tahun 1869, lalu John C.Maxwell pada tahun 1873 yang melakukan penelitian tentang suatu listrik dan medan listrik.
Setelah itu terdapat Sir Willian Crookes yang pada tahun 1870 melalui suatu penelitian eksperimental menemukan bahwa suatu electron memiliki massa tertentu melalui percobaan penembakan sinar katoda.
Lalu ada lagi penelitian dari E.Goldstein yang menemukan proton bermuatan positif. Kemudian G.J Stoney yang berhasil menemukan suatu partikel penyusun atom yang bermuatan negative yaitu electron. Dan kemudian suatu penelitian oleh Wilhelm Roentgen yang menemukan X-Ray.
Rutherford juga kemudian membuat hipotesis berdasarkan penelitiannya yang mengatakan bahwa terdapat suatu inti atom selain proton yang menjaga keseimbangan atom.
Hipotesis Rutherford ini kemudian dapat dibuktikan oleh James Chadwik pada tahun 1932 dengan menemukan partikel atom yang bermuatan netral yang disebut dengan neutron.
Teori Atom
Teori-teori atom ini selalu mengalami perkembangan-perkembangan dari waktu ke waktu sesuai dengan penemuan-penemuan baru yang ditemukan oleh para ahli.
Teori tentang atom ini telah dimulai sejak abad sebelum masehi. Seorang ahli filsafat Yunani yang bernama Demokritus juga berpendapat bahwa sebuah materi bersifat diskontinu, jika materi tersebut dibelah secara terus-menerus, maka akan didapatkan bagian yang tidak dapat dibelah lagi. Bagian tersebut dinamakan dengan sebuah atom.
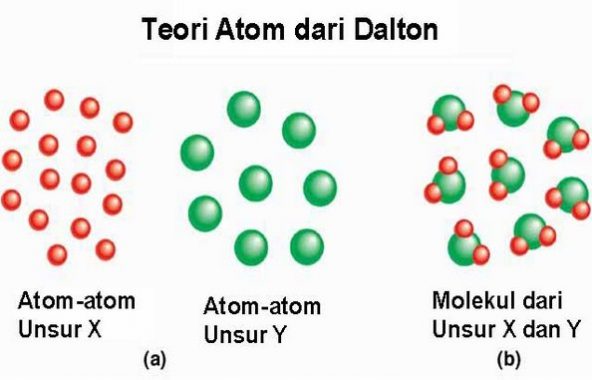
1. Teori Atom Dalton
Teori ini telah disampaikan oleh John Dalton pada tahun 1803 M. Ia berpendapat bahwa berdasarkan dua hukum yang diambil, yaitu hukum kekekalan massa (Lavoisier) dan hukum susunan tetap (hukum Prouts). Dalam hukum kekekalan massa, lavosier ini mengatakan bahwa “massa total zat-zat sebelum reaksi sama dengan massa total zat-zat hasil reaksi”.
Begitu juga dengan hukum susunan tetap, Prouts berpendapat bahwa “perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap”. Dari kedua hukum itu, maka Dalton menarik kesimpulannya yakni :
- Atom merupakan suatu bagian terkecil materi yang tidak dapat dibagi lagi.
- Atom ini berbentuk mirip seperti bola pejal yang snagat kecil, suatu atom memiliki unsur-unsur memiliki atom-atom yang identikdan berbeda dengan unsur yang berbeda.
- Atom-atom ini jika bergabung maka akan membentuk suatu senyawa dengan perbandingan bilangan bulat dan sederhana.
- Reaksi kimia merupakan suatu pemisahan ataupun penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Kelebihan: Mulai bisa membangkitkan minat terhadap penelitian mengenai model atom
Kelemahan: Teori atom Dalton ini tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik. Bagaimana mungkin bola pejal akan dapat menghantarkan arus listrik? Padahal listrik adalah suatu elektron yang bergerak. Berarti ada suatu partikel lain yang dapat menghantarkan arus listrik.
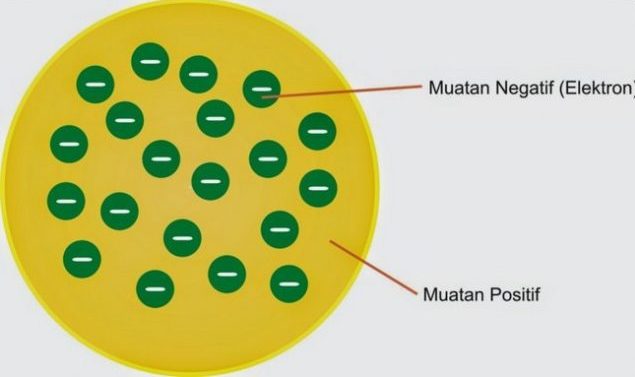
2. Teori Atom Thomson
Teori ini dikemukakan juga oleh Joseph John Thomson. Berawal dari penemuan sebuah tabung katode oleh William Crooker, maka Thompson kemudian meneliti lebih lanjut tentang sinar katode.
Ia menemukan bahwasanya suatu sinar katode merupakan sebuah partikel, karena sinar ini dapat memutar baling-baling yang diletakkan antara katode dan anode. Dari hasil inilah ia dapat menyusun kesimpulan bahwa sinar katode merupakan partikel penyusun atom yang bermuatan negative dan selanjutnya disebut dengan electron.
Lebih lanjut, ia berpendapat bahwa atom merupakan suatu partikel yang bersifat netral, oleh karena electron bermuatan negative, maka harus ada suatu partikel lain yang mampu untuk menteralkan hal tersebut, yaitu partikel positif.
Teori atom Thomson ini berbunyi “Atom merupakan partikel yang berbentuk seperti bola pejal dengan muatan positif, dan dialamnya tersebar muatan negatif”.
Bola atom ini dapat diumpakan seperti pada jambu biji yang terkelupas kulitnya. Elektron di dalam suatu atom persis seperti biji jambu yang tersebar merata di dalam jambu. Teori Thompson ini telah memperbaiki kelemahan dari teori atom Dalton.
Kelebihan : Membuktikan bahwa adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom ini bukan merupakan bagian terkecil dari suatu unsur.
Kelemahan : Model Thomson ini tidak dapat menjelaskan tentang susunan muatan positif dan negatif dalam bola atom tersebut.
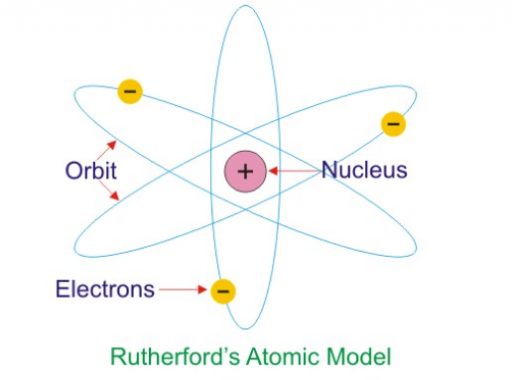
3. Teori Atom Rutherford
Rutherford dibantu oleh dua orang muridnya yaitu Hans Geigerden dan Erners Masreden yang melakukan percobaan yang dikenal dengan hamburan sinar alfa di suatu lempeng emas tipis.
Sebelum dilakukan percobaan ini, terlebih dahulu sudah ditemukan suatu partikel alfa yang bersifat positif dan bergerak lurus, serta berdaya tembus besar, sehingga dapat menembus lembaran tipis emas.
Dari hasil penelitian ini, mereka menemukan bahwasanya ketika ditembakkan sinar alfa ke lempengan tipis emas itu, maka sebagian partikel alfa akan diteruskan (walaupun terdapat penyimpangan sudut kurang dari 1`), tetapi dari pengamatan Marsden ditemukan bahwa satu dari 20.000 partikel alfa ini akan membelok dengan sudut 90` atau bahkan lebih.
Jadi, dapat ditarik kesimpulan yaitu :
Jadi, dapat ditarik kesimpulan yaitu :
- Atom ini bukan berbentuk bola pejal, karena hampir semua partikel alfa diteruskan.
- Jika lempeng emas itu dianggap sebagai lapisan suatu atom-atom emas, maka di dalam atom emas didapat partikel yang sangat kecil bermuatan positif.
- Partikel positif itu merupakan suatu partikel penyusun inti atom, dan ukuran inti atom lebih kecil 10.000 kali dari ukuran atom.
Kelebihan : Dapat membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti. Teori Rutherford bahwa elektron ini mengelilingi inti atom yang memberikan inspirasi pada penemuan baru berikutnya yaitu tentang lintasan atau kedudukan elektron yang selanjutnya dikenal sebagai kulit elektron.
Kelemahan : Tidak dapat menjelaskan mengapa elektron ini tidak jatuh ke dalam inti atom. Berdasarkan teori gerak, apabila elektron yang bergerak mengitari inti disertai pemancaran energi maka lama–kelamaan energi elektron ini akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti.
4. Teori Atom Bohr
Pada tahun 1913, seorang pakar fisika yang bernama Neils Bohr berusaha untuk memperbaiki teori yang dikemukakan oleh Rutherford. Ia juga melakukan sebuah percobaan yang dikenal dengan spectrum atom hydrogen.
Dalam percobaan ini, ia berhasil menemukan suatu gambaran mengenai bagaimana keadaan electron yang menempati daerah inti atom. Teori Bohr ini menggabungkan antara teori mekanika kuantum yang ditemukan oleh Planck dengan teori Rutherford yang dikemukakan oleh Rutherford.
Kemudian, Bohr juga mengungkapkan empat postulatnya, yaitu :
- Hanya terdapat seperangkat orbit tertentu yang boleh bagi satu electron dalam satu atom hydrogen. Orbit ini dikenal juga dengan orbit stationer (menetap) electron dan merupkaan lintasan melingkar di sekeliling inti.
- Selama electron ini berada di lintasan stationer, energy elektorn akan tetap sehingga tidak ada energy dalam bentuk radiasi yang dipancarkan atau diserap.
- Elektron ini dapat berpindah dari satu lintasan stationer ke lintasan stationer yang lain. Perpindahan ini juga akan memakan suatu energi sesuai dengan persamaan Plank E2-E1 =hf.
- Lintasan stationer yang dibolehkan ini memiliki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut.
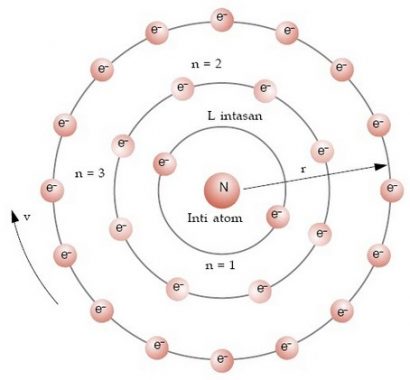
Bohr juga mengungkapkan bahwa suatu electron-elektron mengelilingi inti pada lintasan-lintasan tertentuyang disebut kulit electron atau kulit energi. Tingkat energi yang paling rendah ini adalah kulit electron yang paling dalam, dan semakin besar nomor kulitnya, maka semakin besar tingkat energinya.
Kelebihan : Atom Bohr adalah suatu atom terdiri dari beberapa kulit untuk tempat berpindahnya elektron.
Kelemahan : Model atom ini adalah tidak dapat menjelaskan suatu efek Zeeman dan efek Strack.
Model Atom
1. Model Atom Dalto
Model atom yang sangat sederhana yaitu model atom dalton, yang telah dikemukakan oleh John Dalton, seorang ilmuwan asal kebangsaan Inggris. Menurut dari model atom ini, atom adalah bola pejal yang tidak memiliki muatan.
Kemudian, menurut teori atom ini, atom yaitu kesatuan terkecil yang dapat dibagi-bagi lagi. Jika unsur kimia yang berbeda akan mempunyai jenis atom yang berbeda-beda juga.
2. Model Atom Thompson
Model atom yang kedua yaitu model atom Thompson. Sesuai pada namanya, model atom satu ini dikemukakan oleh Joseph John Thompson. Model atom Thompson memiliki bentuk seperti roti kismis.
Hal itu dikarenakan atom adalah suatu bola padat yang bermuatan positif pada partikel negatif (elektron) yang tersebar didalamnya. Kemudian, muatan positif dan negatif yang ada pada atom tersebut jumlahnya sama. Model atom ini telah dibuktikan pada penelitian Thomson yang memakai sinar tabung katoda.
3. Model Atom Rutherford
Model atom Rutherford telah dikemukakan oleh Ernest Rutherford di tahun 1911. Pada teori atom ini, setiap atom mempunyai kandungan inti atom yang bermuatan positif pada elektron yang mengelilingi didalamnya.
Kemudian, massa atom ini terpusat pada inti atom dan sebagian besar volume atom ini yaitu ruang hampa, Karena telah dibuktikan dari hasil percobaan penembakan logam dari sinar alpha, yang sudah dikenal sebagai Percobaan Geiger-Marsden.
4. Model Atom Bohr
Model atom Bohr dikemukakan oleh Niels Bohr dan Ernest Rutherford di tahun 1913. Pada model atom Bohr merupakan bahwa atom terdiri berdasarkan pada inti atom yang mempunyai kandungan proton dan neutron kemudian dikelilingi oleh elektron yang berputar pada orbitnya (tingkat energi tertentu). Orbit dikenal juga sebagai kulit atom.
5. Model Atom Mekanika Kuantum
Model atom mekanika kuantum adalah model atom yang sangat modern sekali. Atom ini terdiri berdasarkan pada inti atom bermuatan positif dan awan-awan elektron yang mengelilinginya. Daerah tempat ditemukannya elektron yang diberi nama orbital. Menurut pada teori ini, ada empat jenis orbital yakni s, p, d, f.
Partikel Dasar Atom
Seperti yang telah disebutkan di atas, atom juga sebenarnya dikelilingi oleh proton yang ebrmuatan positif, neutron yang bermuatan netral, dan electron yang bermuatan negatif.
Adanya partikel dasar ini tidak terlepas dari pengaruh suatu gaya elektromagnetik yang mengikat partikel-pertikel ini. Pengertian dari masing-masing partikel dasar suatu atom adalah sebagai berikut :
1. Proton
Proton merupakan suatu partikel dasar yang memiliki muatan positif (+1) dan memiliki diameter hanya 1/3 diameter electron. Akan tetapi, proton ini memiliki massa sekitar 1840 kali electron.
Proton merupakan suatu partikel dasar yang memiliki muatan positif (+1) dan memiliki diameter hanya 1/3 diameter electron. Akan tetapi, proton ini memiliki massa sekitar 1840 kali electron.
2. Neutron
Neutron merupakan suatu partikel dasar yang tidak memiliki muatan (netral), dan memiliki massa yang sama dengan gabungan antara massa proton dan massa electron.
Neutron merupakan suatu partikel dasar yang tidak memiliki muatan (netral), dan memiliki massa yang sama dengan gabungan antara massa proton dan massa electron.
3. Elektron
Merupakan suatu partikel dasar yang memiliki muatan negative (-1) dan memiliki massa paling ringan diantara partikel lainnya yang hanya 1/1840 kali massa proton atau neutron.
Merupakan suatu partikel dasar yang memiliki muatan negative (-1) dan memiliki massa paling ringan diantara partikel lainnya yang hanya 1/1840 kali massa proton atau neutron.
Partikel – Partikel Atom
1. Partikel Subatom
Walaupun definisi atom menyebutkan bahwa atom ialah suatu bagian terkecil dari material yang tidak dapat dibagi lagi, dalam ilmu modern, atom sendiri tersusun atas beberapa partikel subatom. Partikel subatom ini juga meliputi proton, elektron dan neutron.
2. Inti Atom
Inti atom ini terdiri atas proton dan neutron yang terikat di inti atom oleh suatu gaya elektromagnetik. Proton dan nutron itu disebut juga dengan nucleon (penyusun inti).
Inti atom ini memiliki diameter berkisar 10-15 nm. Atom dari suatu unsur kimia yang sama memiliki jumlah proton yang sama pula. Suatu unsur dapat memiliki variasi jumlah neutron yang disebut juga dengan isotop.
3. Awan Elektron
Awan partikel merupakan suatu daerah dalam sumur potensi dimana tiap-tiap electron yang menghasilkan sejenis gelombang diam (gelombang yang tidak bergerak).
Sifat – Sifat Atom
1. Sifat Nuklir
Sifat nuklir (radioaktif) ini hanya dimiliki oleh unsur-unsur atom yang memiliki nomor atom lebih dari 82. Dari sekitar 339 nuklida yang sudah ditemukan secara alami di dalam bumi, sebanyak 269 diantaranya belum terpantau secara menyeluruh.
Pada unsur kima, 80 dari unsur yang telah diketahui memiliki satu atau lebih isotope stabil. Unsur 43, 63, dan semua unsur yang memiliki nomor atom lebih dari 82 ini tidak memiliki isotope stabil. Hal inilah yang dapat menyebabkan unsur tersebut memiliki sifat radioaktif.
2. Massa Atom
Jumlah keseluruhan dari partikel dasar dalam suatu atom disebut juga dengan nomor massa. Massa atom dalam keadaan diam ini dinilai dengan menggunakan satuan Dalton.
Massa atom dalam unsur yang berbeda ini memiliki massa yang bervariasi. Massa tersebut tergantung dari jumlah suatu proton dan neutron dalam intinya. Semakin besar massa atom, maka akan semakin kecillah atom tersebut.
3. Nomor Atom
Atom-atom dalam zat yang berbeda ini memiliki jumlah proton yang tidak sama dalam intinya. Jumlah proton dalam inti ini disebut juga dengan nomor atom.
4. Gaya Atom
Gaya elektromagnetik ini menjaga elektron yang bermuatan negatif agar tetap berada orbit sekeliling inti muatan positif. Terdapat gaya tarik inti yang merupakan suatu gaya paling kuat yang menjaga proton dan neutron tetap berada dalam inti atom. Gaya inti seratus kali lebih kuat daripada suatu gaya elektromagnetik.
Susunan Atom
Susunan suatu atom yang satu dengan yang lainnya memiliki perbedaan, baik dari jumlah proton, elektron, dan jumlah neutron. Berikut penjelasannya :
- Nomor Atom
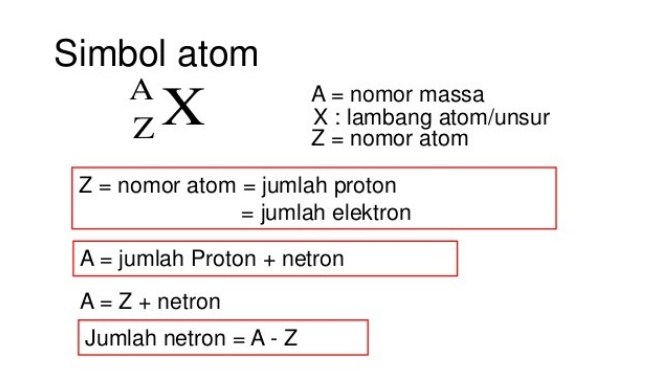
Nomor atom merupakan suatu jumlah proton yang terdapat di inti atom. Nomor atom ini disebut juga nomor proton. Atom dari unsur yang sama mempunyai jumlah proton yang sama juga tetapi berbeda dari atom unsur lain. Atom yang bersifat netral ini akan memiliki jumlah elektron (e) sama dengan jumlah proton (p).
Nomor atom (Z)= Jumlah proton (p) = jumlah elektron (e)
- Nomor Massa
Nomor massa adalah suatu jumlah proton dan jumlah neutron dalam suatu atom. Dalam suatu atom ini hanya ditentukan oleh banyaknya massa proton dan neutron.
Hal ini karena pada massa proton dan neutron memiliki jumlah yang sama (1 atm), sedangkan massa elektron sangat kecil (<1 atm) sehingga massa elektron diabaikan.
Nomor massa (A)= jumlah proton (p) + jumlah neutron (n)
Pada atom yang bermuatan yaitu bermuatan positif dan bermuatan negatif ini memiliki jumlah proton dan elektron yang berbeda.
Jumlah proton (p) = Z
Jumlah elektron (e) = Z – muatan
Jumlah neutron (n) = A – Z
Jumlah elektron (e) = Z – muatan
Jumlah neutron (n) = A – Z
- Isotop, Isobar, dan Isoton
1. Isotop
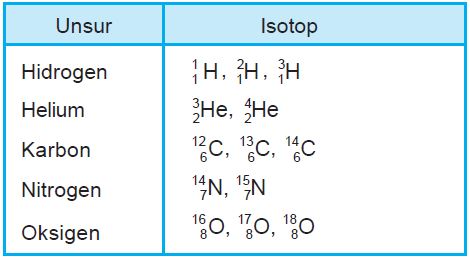
Isotop adalah suatu atom yang mempunyai nomor atom sama, tetapi nomor massa berbeda. Perbedaan jumlah neutron dalam suatu atom-atom menyebabkan perbedaan massa atom-atom tersebut.
Agar lebih mudah untuk memahami yaitu dengat mengingat top artinya atas. Jadi yang beda adalah atasnya saja yaitu nomor massanya.
Contohnya :
Isotop Hidrogen
Isotop Karbon
Isotop Oksigen
Isotop Nitrogen
Isotop Helium
Isotop Hidrogen
Isotop Karbon
Isotop Oksigen
Isotop Nitrogen
Isotop Helium
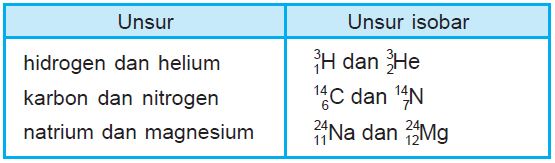
2. Isobar
Dalam ilmu komputer juga ada istilah toolbar yang letaknya dibawah. Untuk dapat memudahkan kita dalam memahami Isobar, maka asumsikan seperti toolbar.
Jadi yang berbeda adalah pada bagian yang bawahnya. Isobar adalah suatu atom dari unsur yang berbeda (juga memiliki nomor atom berbeda) tetapi mempunyai nomor massa sama.
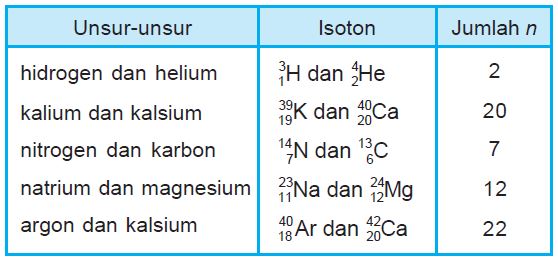
3. Isoton
Isoton adalah suatu atom dari unsur yang berbeda (juga memiliki nomor atom) tetapi jumlah neutronnya sama.
Semoga dapat bermanfaat dan memberikan ilmu pengetahuan serta wawasan yang luas lagi bagi para pembaca artikel ini. Sekian dan Terima Kasih.

Tidak ada komentar:
Posting Komentar