Pengertian Laju Reaksi
Laju Reaksi ialah sebuah laju penurunan ( reaktan atau pereaksi ) atau juga laju bertambahnya ( hasil reaksi atau produk ). Laju reaksi ini juga menggambarkan cepat atau lambatnya suatu reaksi kimia.
Sedangkan reaksi kimia merupakan sebuah proses untuk bisa mengubah zat (pereaksi) menjadi zat yang baru dan disebut sebagai produk.
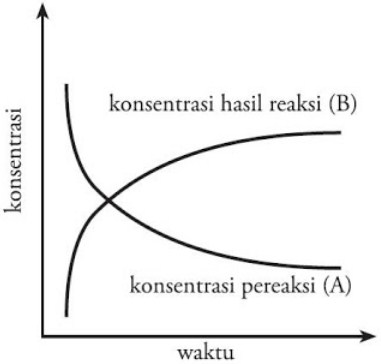
Laju reaksi sama dengan kecepatan suatu reaksi. Untuk suatu reaksi dengan reaktan A dan B menghasilkan produk C dan D, seiring waktu dengan jumlah molekul reaktan A dan B juga akan berkurang dan jumlah molekul suatu produk C dan D akan bertambah.
Tanda negatif pada sebuah laju perubahan diatas konsentrasi reaktan A dan B (reaktan) ditujukan supaya nilainya bisa menjadi positif, sebagaimana laju reaksi adalah suatu besaran yang nilainya harus selalu juga positif. Satuannya adalah M s-1 atau juga mol L-1 s-1.
Faktor Laju Reaksi
Faktor – Faktor Yang Mempengaruhi Laju Reaksi Yaitu Sebagai Berikut :
1. Konsentrasi Pereaksi
Konsentrasi ini memiliki peranan yang sangat penting dalam laju reaksi, sebab semakin besar suatu konsentrasi pereaksinya, maka tumbukan yang akan terjadi juga akan semakin banyak, sehingga dapat menyebabkan laju reaksi itu semakin cepat.
Begitu pula, apabila semakin kecil suatu konsentrasi pereaksi, maka akan semakin kecil juga tumbukan yang akan terjadi antar partikelnya, sehingga laju reaksinya pun akan semakin kecil.
2. Pengaruh Suhu
Suhu juga termasuk berperan dalam mempengaruhi suatu laju reaksi. Apabila suhu pada suatu rekasi yang akan berlangsung pada saat dinaikkan, maka akan menyebabkan sebuah partikel itu akan semakin aktif bergerak, sehingga tumbukan yang terjadi akan semakin sering, menyebabkan laju reaksi yang semakin besar.
Sebaliknya, apabila suhu diturunkan, maka partikelnya akan semakin tak aktif lagi, sehingga laju reaksinya pun menjadi semakin kecil.
3. Temperatur
Semakin tinggi temperatur maka akan semakin tinggi energi kinetik dari partikel reaktan, sehingga frekuensi tumbukan dan energi tumbukan menjadi meningkat.
Oleh karena itu, semakin tinggi temperatur, laju reaksi juga akan semakin cepat. Sebagai contoh, pada reaksi glowing stick yang menyala (reaksi chemiluminescence), glowing stick akan menyala lebih cepat dan terang di dalam air panas dibanding dalam air dingin.
4. Keberadaan Katalis
Katalis adalah suatu zat yang dapat mempercepat laju reaksi, tanpa terkonsumsi di dalam suatu reaksi tersebut. Katalis ini juga menyediakan alternatif jalur reaksi dengan energi suatu aktivasi yang lebih rendah dibanding jalur reaksi tanpa katalis sehingga reaksinya akan menjadi semakin cepat.
5. Luas Permukaan Sentuh
Luas permukaan sentuh ini juga memiliki peranan yang sangat penting dalam sebuah laju reaksi tersebut, sebab semakin besar luas permukaan bidang sentuh antar partikelnya, maka akan semakin banyak juga tumbukan yang terjadi, sehingga menyebabkan laju reaksi tersebut menjadi semakin cepat.
Begitu juga sebaliknya, apabila semakin kecil luas permukaan bidang sentuhnya, maka akan semakin kecil tumbukan yang terjadi antar partikelnya, sehingga laju reaksi pun akan menjadi semakin kecil.
Teori Tumbukan
Teori tumbukan juga menyatakan bahwa partikel-partikel reaktan harus saling bertumbukan untuk bisa bereaksi. Tumbukan antar partikel reaktan yang berhasil menghasilkan suatu reaksi disebut juga sebagai tumbukan efektif. Energi minimum yang harus dimiliki oleh suatu partikel reaktan untuk bertumbukan efektif disebut juga dengan energi aktivasi (Ea).
Pada dasarnya, laju reaksi ini bergantung pada seperti berikut ini :
1. Orientasi (arah) tumbukan partikel
Pada reaksi umumnya, sebuah partikel harus dalam orientasi yang tertentu ketika bertumbukan supaya tumbukan yang terjadi efektif akan menghasilkan reaksi.
Sebagai contoh, perhatikan beberapa tumbukan yang mungkin akan terjadi antara molekul gas NO dan molekul gas NO3 dalam reaksi seperti berikut :
NO(g) + NO3(g) → 2NO2(g)
2. Frekuensi terjadinya tumbukan partikel
Semakin sering terjadinya tumbukan suatu partikel (frekuensi tumbukan tinggi) maka akan semakin besar peluang terjadinya tumbukan efektif sehingga laju reaksi juga akan menjadi semakin cepat.
3. Energi partikel reaktan yang bertumbukan
Energi partikel reaktan yang bertumbukan juga harus melampaui energi aktivasi, yakni suatu energi penghalang terjadinya reaksi, sehingga reaksi dapat juga terjadi. Bila energi aktivasi semakin rendah, maka laju reaksinya juga akan menjadi semakin cepat.
Hukum atau Rumus Laju Reaksi
Hukum laju (persamaan laju) ini bisa dinyatakan dalam hubungan antara laju reaksi dengan konsentrasi dari reaktan yang dipangkatkan suatu bilangan tertentu.
Untuk reaksinya :
aA + bB → cC + dD
Maka hukumya yaitu :
v = k [A]x [B]y
Di mana nilai konstanta pada laju, k dan nilai x dan y yang ditentukan berdasarkan sebuah eksperimen, bukan karena berdasarkan koefisien stoikiometrinya persamaan reaksi setara.
Untuk reaksi tersebut, dapat dikatakan reaksi orde karena saat ke-x terhadap A, orde ke-y terhadap B, dan orde reaksi total sama dengan x + y.
Semoga bermanfaat dan bisa menambbaha ilmu pengetahuan bagi para pencari ilmu. Terima Kasih.

Tidak ada komentar:
Posting Komentar