Pengertian Termodinamika
Kata Termodinamika ini bersalah dari bahasa Yunani yaitu “Thermos” yaitu “Panas” dan “Dynamic” yakni “Perubahan”.
Termodinamika merupakan salah satu ilmu yang menggambarkan usaha untuk mengubah kalor (perpindahan energi yang disebabkan perbedaan suhu) menjadi energi serta sifat-sifat pendukungnya.
Termodinamika ini sendiri ditemukan dan juga diteliti pada awal abad 18. Termodinamika berhubungan erat dengan fisika energi, panas, kerja, entropi dan kespontanan proses.
Prinsip – Prinsip Termodinamika
Penerapan prinsip-prinsip termodinamika yang meliputi Mekanika, Panas dan Kalkulus Diferensial.
Penyelesaian suatu masalah atau problema secara termodinamika dilakukan melalui beberapa tahapan, yakni sebagai berikut :
- Formulasi problem ke dalam besaran & bentuk termodinamika. Hal ini yang dikatakan sebagai mengubah bahasa dalam problem ke dalam bahasa termodinamika, kemudian merumuskannya dengan menggunakan besaran-besaran termodinamika.
- Evaluasi sifat dan fungsi termodinamika, berarti melakukan analisis terhadap formulasi yang telah disusun pada langkah pertama (1).
- Tahap ini membutuhkan pemahaman pengetahuan termodinamika yang memadai agar tidak terjadi kesalahan persepsi terhadap arah atau tujuan problema tersebut.
- Penyelesaian problem termodinamika. Pada tahap ini dibutuhkan dukungan pengetahuan matematika atau kalkulus (deferensial, integral) sehingga dapat diperoleh jawaban yang valid atau bisa dipertanggungjawabkan.
- Ketiga langkah penyelesaian termodinamika tersebut harus berpijak pada dalil-dalil atau kaidah-kaidah dalam termodinamika.
Dengan berkembangnya ilmu pengetahuan dan teknologi, termodinamika direkayasa sedemikian rupa sehingga menjadi suatu bentuk mekanisme yang bisa membantu manusia dalam kegiatannya.
Aplikasi termodinamika yang begitu luas dimungkinkan karena adanya perkembangan ilmu termodinamika sejak abad 17.
Pengembangan ilmu termodinamika dimulai dengan pendekatan makroskopik yakni perilaku umum partikel zat yang menjadi media pembawa energi.
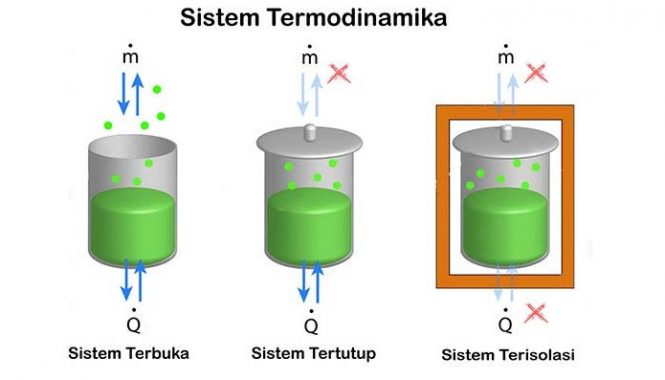
Sistem Termodinamika
1. Sistem Tertutup
Terjadi pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran benda dengan lingkungan.
Rumah hijau ialah contoh dari sistem tertutup di mana terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja dengan lingkungan.
Apakah suatu sistem terjadi pertukaran panas, kerja atau keduanya biasanya dipertimbangkan sebagai sifat pembatasnya yakni :
- Pembatas Adiabatik : Tidak memperbolehkan pertukaran panas
- Pembatas Rigid : Tidak memperbolehkan pertukaran kerja.
2. Sistem Terisolasi
Tak terjadi pertukaran panas, benda atau kerja dengan lingkungan. Contoh dari sistem terisolasi adalah wadah terisolasi, seperti tabung gas terisolasi.
3. Sistem Terbuka
Terjadi pertukaran energi (panas dan kerja) dan benda dengan lingkungannya.
Sebuah pembatas memperbolehkan pertukaran benda disebut permeabel. Samudra merupakan contoh dari sistem terbuka.
Hukum Dasar Termodinamika
1. Hukum Termodinamika I
“Jumlah kalor yang ada pada suatu sistem ialah sama dengan perubahan energi yang ada di dalam sistem tersbeut ditambah dengan usaha yang dilakukan oleh sistem.”
Rumus Hukum Termodinamika I
Q = ∆U + W ataupun ∆U = Q – W
Keterangan :
- ∆U = Perubahan energi dalam sistem (J)
- Q = Kalor yang diterima ataupun dilepas sistem (J)
- W = Usaha (J)
2. Hukum Termodinamika II
“Kalor bisa mengalir secara alami dari benda yang memiliki suhu panas ke benda yang memiliki suhu lebih dingin; kalor tidak bisa mengalir secara spontan dari benda dingin ke benda panas tanpa dilakukan sebuah usaha”.
Penjelasan Hukum Termodinamika II, yakni :
- Tidak akan mungkin membuat mesin yang bisa bekerja di dalam satu siklus, menerima kalor dari satu reservoir serta mengubah kalor seluruhnya menjadi usaha.
- Tidak akan mungkin membuat mesin yang dapat bekerja di dalam satu siklus dengan mengambil kalor dari reservoir yang memiliki suhu rendah dan memberikannya ke reservoir yang memiliki suhu lebih tinggi tanpa adanya usaha dari luar.
- Mesin yang bekerja di antara reservoir suhu Tt dan reservoir suhu Tt (Tt > Tr), memiliki efisiensi yang maksimum.
3. Hukum Termodinamika III
Hukum ketiga termodinamika terkait dengan temperatur nol absolut. Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum.
Hukum ini dapat menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Pengertian Entropi
” Entropi bisa diartikan sebagai ukuran ketidakberaturan, di dalam sistem yang tertutup poningkatan entropi oleh penurunan jumlah energi yang tersedia, semakin tinggi entropi maka akan semakin tinggi juga ketakberaturannya”.
Jenis – Jenis Entropi
1. Entropi Pada Proses Temperatur Konstan
Apabila suatu sistem yang ada pada suhu mutlak T mengalami proses reversible dengan menyerap sejumlah kalor Q maka kenaikan entropi ∆S.
Rumus :
∆S = S2 – S1 = Q/T
Keterangan :
- ∆S : Perubahan entropi (J/K)
- S1 : Entropi mula-mula (J/K)
- S2 : Entropi akhir (J/K)
2. Entropi Pada Proses Temperatur Berubah
Rumus :
∆S = mc In (T2/T1)
Keterangan :
- ∆S : Perubahan entropi (J/K)
- S1 : Entropi mula-mula (J/K)
- S2 : Entropi akhir (J/K)
- c : Kalor jenis (J/kg K)
- m : Massa (kg)
- T1 : Suhu mula-mula (K)
- T2 : Suhu akhir (K)
Semoga bermanfaat dan bisa menambah ilmu pengetahuan bagi para pencari ilmu. Terima Kasih.
Tidak ada komentar:
Posting Komentar